-
Tabla de contenido
Bohr: Características del Modelo Atómico
Introducción
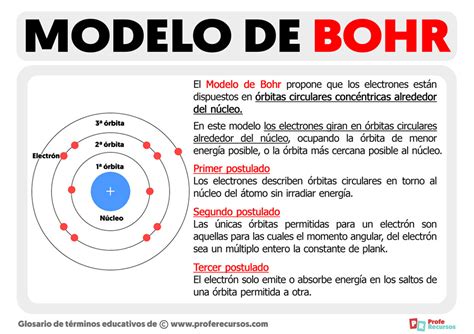
El modelo atómico de Bohr, propuesto por el físico danés Niels Bohr en 1913, revolucionó nuestra comprensión de la estructura de los átomos. Este modelo introdujo la idea de niveles de energía cuantizados y explicó de manera efectiva la estabilidad de los átomos. En este artículo, exploraremos las características clave del modelo atómico de Bohr y su impacto en la física moderna.
Niveles de Energía Cuantizados
Una de las características más importantes del modelo atómico de Bohr es la idea de niveles de energía cuantizados. Según este modelo, los electrones en un átomo pueden ocupar solo ciertos niveles de energía discretos, en lugar de moverse de manera continua alrededor del núcleo. Estos niveles de energía están representados por órbitas circulares alrededor del núcleo, cada una con una energía específica.
Salto Cuántico
Bohr también introdujo el concepto de salto cuántico, que ocurre cuando un electrón cambia de un nivel de energía a otro. Durante un salto cuántico, el electrón absorbe o emite energía en forma de fotones. Este fenómeno es fundamental para entender la emisión y absorción de luz por parte de los átomos.
Estabilidad de los Átomos
Otra característica importante del modelo atómico de Bohr es su capacidad para explicar la estabilidad de los átomos. Según este modelo, los electrones en un átomo ocupan órbitas estables alrededor del núcleo, lo que evita que colapsen hacia el núcleo debido a la fuerza electrostática entre las cargas opuestas. Esta estabilidad se debe a que los electrones solo pueden ocupar ciertos niveles de energía, lo que mantiene el átomo en equilibrio.
Espectro Atómico
El modelo atómico de Bohr también proporciona una explicación para los espectros de emisión y absorción de los átomos. Según este modelo, los electrones en un átomo pueden saltar entre niveles de energía, emitiendo o absorbiendo fotones en el proceso. Estos fotones tienen energías específicas, lo que da lugar a líneas espectrales distintas en el espectro de un átomo.
Impacto en la Física Moderna
El modelo atómico de Bohr tuvo un impacto significativo en la física moderna y sentó las bases para el desarrollo de la mecánica cuántica. Este modelo ayudó a explicar fenómenos como la estabilidad de los átomos, los espectros atómicos y la interacción entre la luz y la materia. Además, el modelo de Bohr allanó el camino para futuras investigaciones en el campo de la física cuántica.
Contribuciones a la Teoría Cuántica
El modelo atómico de Bohr fue un paso crucial hacia la comprensión de la naturaleza cuántica de los átomos. Sus ideas sobre niveles de energía cuantizados y saltos cuánticos sentaron las bases para la teoría cuántica, que describe el comportamiento de las partículas subatómicas a escalas muy pequeñas. Gracias a las contribuciones de Bohr, hoy en día tenemos una comprensión más profunda de la física a nivel atómico y subatómico.
Conclusión
En resumen, el modelo atómico de Bohr introdujo conceptos revolucionarios que cambiaron nuestra comprensión de la estructura de los átomos. Sus ideas sobre niveles de energía cuantizados, saltos cuánticos y estabilidad atómica han sido fundamentales para el desarrollo de la física moderna. El legado de Niels Bohr vive en la teoría cuántica y en nuestra comprensión del mundo subatómico.